

Vol. 39 (Nº 42) Ano 2018 • Página 21
Letícia Queiroz de Souza CUNHA 1; Lúcia Filgueiras BRAGA 2
Recebido: 25/04/2018 • Aprovado: 10/06/2018
RESUMO: Objetivou-se avaliar eficiência dos métodos combinados de hidratação e estratificação por diferentes períodos para superação da dormência; influência do tempo de armazenamento e tamanho de semente sobre a germinação. Avaliou-se: comprimento raiz, percentagem de germinação e emergência, tempo médio, índice de velocidade de emergência e de sincronização. A. mucosa apresentou dormência embrionária. Hidratação por 48 horas + estratificação por 20-25 dias promove superação de dormência. Armazenamento por 30 ou 60 dias reduz dormência embrionária. Sementes maiores originam plântulas mais vigorosas. |
ABSTRACT: The objective was to evaluate the efficiency of the combined methods of hydration and stratification by different periods to overcome dormancy; influence of storage time and seed size on germination. It was evaluated: root length, percentage of germination and emergence, mean time, emergency speed index and synchronization. The mucosa presented embryonic numbness. Hydration for 48 hours + stratification for 20-25 days promotes overcoming of numbness. Storage for 30 or 60 days reduces embryonic dormancy. Larger seeds yield more vigorous seedlings. |
A família Annonaceae agrupa espécies importantes para a fruticultura comercial em diversas regiões do mundo (KAVATI e DONADIO, 2011). Entre seus representantes está Annona mucosa Jacq., planta cultivada com frequência em pomares domésticos cujo fruto é altamente nutritivo com sabor suave e adocicado consumido principalmente in natura. Todas as partes da planta são utilizadas na medicina popular e estudo recente revelou a presença de substâncias com comprovada ação antiprotozoário, antimicrobiana e antifúgica (DE SOUZA BARBOZA et al., 2015) e como biopesticida (KRINSKI et al., 2014). Sua madeira é utilizada na confecção de esteios, canoas, pranchas e caixas (SANTOS et al., 2009).
Os frutos de A. mucosa abrigam várias sementes, de coloração escura, com dormência fisiológica, tegumentar e presença de substâncias inibidoras da germinação que culminam no retardo da germinação, mesmo em condições ambientais favoráveis, caracterizando-a como lenta e desuniforme (FERREIRA et al., 2007) dificultando a produção de mudas (FLORIANO, 2004). Desta forma, faz-se necessário o desenvolvimento de métodos que proporcionem a superação da dormência e favoreça a propagação da espécie e sua utilização em larga escala.
Existem vários métodos para superação dos diferentes tipos de dormência, dentre eles está a imersão em água, utilizada para sementes que apresentam dificuldades em germinar, geralmente, em decorrência de longos períodos de armazenamento (FOWLER e BIANCHETTI, 2000). Também há a estratificação, a qual promove a interação de oxigênio, temperatura e umidade (LABORIAU, 1983), evita o dessecamento das sementes, aumenta a tensão de gás carbônico e reduz a de oxigênio resultando na maturação ou superação de bloqueios à germinação (CUNHA e FERREIRA, 1987). Contudo a utilização deste método é relacionada à existência de dormência embrionária pela presença de embrião imaturo (TAVARES et al., 2015), o que não foi relacionado como ocorrente em A. mucosa.
O armazenamento das sementes pode constituir estratégia para superação de dormência, considerando que esse período pode promover equilíbrio entre as substâncias promotoras e inibidoras do crescimento, diminuição da resistência mecânica e da impermeabilidade da cobertura a gases e água e amadurecimento do embrião (JULHO, 2005). Tais fatos resultam em germinação rápida e uniforme, contribuindo para acelerar a produção de mudas e o estabelecimento inicial das plantas no campo (ROVERSI et al., 2002).
A germinação e o desenvolvimento da plântula também podem ser afetados pelo tamanho das sementes. Geralmente sementes de maior comprimento, largura e espessura são mais pesadas e apresentam qualidade fisiológica superior às mais leves (BEZERRA et al., 2004) originando plântulas mais robustas. Elucidar mecanismos envolvidos na germinação a fim de gerar tecnologia é ponto de partida para produção de mudas de qualidade (LULA et al., 2000) e em quantidade para atender a demanda do mercado consumidor, além de contribuir para a manutenção da espécie.
Diante do exposto, este trabalho avaliou a eficiência dos métodos combinados de hidratação em água e estratificação por diferentes períodos para a superação de dormência de sementes de Annona mucosa e a influência do tempo de armazenamento e tamanho da semente sobre a germinação.
O trabalho foi conduzido em viveiro de mudas coberto com tela de sombreamento 50% de sombreamento, situado na zona rural de Matupá-MT, com latitude de 10º 03' 27" S, longitude de 54º 55' 58" W e altitude de 280 m, durante o mês de maio e junho de 2016. O clima desta região é definido, segundo Köppen-Geiger, como tropical de savanas Aw, com temperatura média anual de 25,3ºC e precipitação anual em torno de 2.255 mm.
As sementes de Annona mucosa foram obtidas de 105 frutos maduros retirados de sete matrizes, oriundas do município de Matupá-MT, no período de fevereiro a abril de 2016. As sementes foram separadas manualmente e lavadas em água corrente, colocadas sob papel toalha e secas por 24 horas em bancada à sombra.
Para avaliar a influência da hidratação e tempo de estratificação na germinação de sementes, foi utilizado um delineamento experimental inteiramente casualizado em esquema fatorial 2 x 3 (sem hidratação e com hidratação por 48 horas x tempos de estratificação em areia - 15, 20 e 25 dias), totalizando seis tratamentos com quatro repetições de 25 sementes cada.
Duas amostras de 300 sementes, após a secagem por 24 horas, foram armazenadas por 60 dias, acondicionadas em sacos de papel Kraft, sobre bancada a sombra, em ambiente de laboratório com circulação de ar e média de temperatura 25ºC. Após período de armazenamento, uma subamostra foi hidratada, acondicionada em balde contendo 2 litros de água destilada para embebição durante 48 horas.
Na sequência sementes hidratadas e não hidratadas passaram por assepsia em solução de hipoclorito de sódio (2,0% de cloro ativo) por 10 minutos, lavagem em água destilada por 5 minutos e tratamento com fungicida Captan SC 480 (Captan), a 0,5% do peso das sementes. Em seguida, sementes hidratadas e não hidratadas foram divididas em quatro repetições de 25 sementes cada, para estratificação em baldes de 3,6 litros (19 cm altura e 16 cm diâmetro) com furos para drenagem, sendo utilizado um balde para cada repetição. No fundo do balde adicionou-se 5 cm de pedra brita tipo 2, seguida de 5 cm de areia com granulometria média sobre a qual uma repetição de 25 sementes foi distribuída e coberta com outra camada de 5 cm de areia, procedimento realizado em todas as repetições. A areia foi umedecida com volume de água destilada suficiente para máxima capacidade de retenção, o que foi definido em teste prévio. A areia e pedra utilizadas foram previamente autoclavadas por 1 hora à temperatura de 120oC.
Os baldes (sem tampa) foram mantidos em viveiro coberto com filme plástico para estufa agrícola com 150 microns e tela de sombreamento 50%, com irrigação de forma a fornecer 1 litro de água a cada 2 dias, para manutenção da umidade. Monitorou-se a temperatura da areia e do ambiente diariamente pela manhã, tarde e noite (06:00, 15:00 e 20:00 horas), utilizando termômetro de vidro para a areia e termohigrômetro digital para o ambiente.
Aos 15, 20 e 25 dias, quatro repetições de 25 sementes hidratadas e não hidratadas previamente foram avaliadas, retiradas manualmente e separadas da areia com auxílio de peneira grossa e avaliados a porcentagem de sementes germinadas e o comprimento da raiz em cada período de estratificação.
Os cálculos de porcentagem de germinação foram realizados de acordo com Labouriau e Valadares (1976). Considerou-se germinada a semente com raiz primária igual ou superior à 2 mm (REHMAN et al., 1996).
O comprimento da raiz das plântulas foi avaliado em conjunto com o teste de germinação, utilizando-se todas as plântulas, medidas com auxílio de paquímetro digital com precisão de 0,01 mm. Os comprimentos, para cada repetição, foram calculados dividindo-se o total das medidas pelo número de plântulas avaliadas, obtendo-se valores médios.
Com o objetivo de avaliar períodos de armazenamento e de estratificação das sementes foi adotado delineamento inteiramente casualizado em esquema fatorial 3 x 3
(períodos de armazenamento das sementes - 0, 30 e 60 dias x tempos de estratificação em areia - 15, 20 e 25 dias), totalizando nove tratamentos com quatro repetições de 25 sementes cada.
Foram utilizadas três amostras com 300 sementes cada, duas delas armazenadas por 30 e 60 dias, nas mesmas condições de embalagem e ambiente descritas anteriormente. As sementes de cada período de armazenamento (0 – considerado 24 horas após retirada do fruto, 30 e 60 dias) foram submetidas a hidratação por 48 horas, passaram por assepsia e tratamento com fungicida conforme descrito no experimento 1. Da mesma forma foram realizados os procedimentos de montagem da estratificação, irrigação e monitoramento de temperatura e umidade. Doze amostras com 10 sementes cada, quatro para cada período de armazenamento (60, 30 e 0 dias), foram separadas para determinação do teor de água das sementes. Foi utilizado o método da estufa a 105 ± 3°C, durante 24 horas, segundo as Regras para Análise de Sementes (BRASIL, 2009), com valores expressos em porcentagem.
Após 15, 20 e 25 dias, as quatro repetições de 25 sementes de cada período de armazenamento foram retiradas dos baldes, avaliada a porcentagem de sementes germinadas e o comprimento de raiz, conforme descrito para o experimento 1.
A temperatura e a umidade foram monitoradas três vezes ao dia, as 6, 13 e 21 horas. Para aferição da temperatura da areia foi utilizado termômetro de vidro e para a temperatura ambiente e umidade do ar termohigrômetro digital int/ext máx/min 7666 Incoterm.
Com o objetivo de avaliar a influência do tamanho das sementes sobre a emergência e crescimento das plantas de A. mucosa foi utilizado delineamento inteiramente casualizado com dois tamanhos de sementes (pequenas e grandes). Para classificação dos lotes de sementes considerou-se sementes pequenas aquelas que apresentaram medida ≤ 16 mm de comprimento, 7 mm de largura e 5 mm de espessura e sementes grandes aquelas com medida ≥ 17 mm de comprimento, 9 mm de largura e 7 mm de espessura (FIGURA 1).
Figura 1
Comprimento, largura e espessura de sementes
de Annona mucosa. Fonte: Do autor (2017).

Foram separadas duas amostras de 100 sementes de cada tamanho, subdivididas em quatro repetições de 25 sementes, que passaram pelos mesmos procedimentos de secagem por 24 horas, armazenamento por 60 dias, hidratação por 48 horas, assepsia e tratamento fungicida, conforme descrito no experimento 1. A estratificação, contudo, foi encerrada aos 10 dias, com a retirada das sementes da areia antes da protrusão da raiz. Após esse período, as sementes foram transferidas para caixas plásticas com volume de 20 litros (14 cm altura x 61 cm comprimento x 38 cm largura) contendo substrato comercial Plantmax®. Cada caixa, subdividida em quatro repetições com 25 sementes, foi mantida em viveiro coberto com filme plástico para estufa agrícola 150 microns e tela de sombreamento 50 %, irrigada de forma a manter a umidade do substrato.
As avaliações da germinação das sementes foram diárias durante 48 dias, iniciando a primeira contagem após a verificação de 10% de plântulas emergidas em relação ao total de sementes semeadas.
Foram avaliados: Porcentagem de Emergência de acordo com Labouriau e Valadares (1976); Índice de velocidade de emergência (IVE) conforme Maguire (1962); Tempo médio de emergência (TME) e Frequência relativa da emergência (Fr) segundo Labouriau e Valadares (1976) e Índice de sincronização conforme Labouriau e Pacheco (1978).
Aos 48 dias, as plântulas emergidas foram retiradas manualmente do substrato para avaliação do Diâmetro de coleto: medido com auxílio de paquímetro digital de precisão 0,01 mm na região distintiva morfologicamente entre parte aérea e raiz, representando a média das plântulas normais por repetição, considerada normal a plântula com estruturas essenciais bem desenvolvidas, completas, proporcionais e sadias com potencial para originar plantas normais, segundo critério descrito nas Regras para Análises de Sementes (BRASIL, 2009). Número de folhas: contadas todas as folhas expandidas das plântulas, representando a média do total de folhas de cada plântula por repetição. Comprimento de parte aérea e raiz: obtidos com auxílio de paquímetro digital de precisão 0,01 mm e calculados dividindo-se o total das medidas pelo número de plântulas avaliadas por repetição, obtendo-se valores médios. Para comprimento da parte aérea mediu-se a distância entre o coleto da muda até o meristema apical caulinar e da raiz a distância do coleto da muda até ápice da raiz principal. Massa seca da parte aérea e raiz: definida como a massa média, correspondente à massa de cada plântula por repetição, utilizando para secagem estufa com circulação de ar, regulada para 65 ± 3ºC até atingir peso constante, com pesagem em balança de precisão 0,001 g, de acordo com metodologia de Nakagawa (1999).
Os dados obtidos dos três experimentos foram submetidos à análise de variância e as médias dos tratamentos foram comparadas pelo Teste de Tukey a 5% de probabilidade, utilizando o programa SISVAR (FERREIRA, 2011).
Experimento 1: A hidratação prévia das sementes favoreceu o processo germinativo de Annona mucosa em todos períodos de estratificação em areia (Tabela 1). Os valores de porcentagem de germinação demonstram que após 15 dias de estratificação apenas 5% das sementes sem hidratação prévia haviam germinado em comparação a 64% das sementes hidratadas e, aos 25 dias, os valores passaram de 48% para 80%.
Tabela 1
Valores médios de porcentagem de germinação e comprimento de raiz de sementes
de Annona mucosa Jacq. com e sem hidratação prévia e estratificadas por diferentes períodos.
Estratificação (Dias) |
Porcentagem de germinação (%) |
|||
Com hidratação |
Sem hidratação |
|||
15 |
64,0 |
aB |
5,0 |
bC |
20 |
75,0 |
aA |
29,0 |
bB |
25 |
80,0 |
aA |
48,0 |
bA |
C.V. (%) = 8,46; DMS (H) = 6,3; DMS (PE) = 7,7 |
||||
Estratificação (Dias) |
Comprimento de raiz (mm) |
|||
Com hidratação |
Sem hidratação |
|||
15 |
6,8 |
aC |
3,3 |
aC |
20 |
17,8 |
aB |
11,2 |
bB |
25 |
33,8 |
aA |
24,5 |
bA |
C.V. (%) = 15,84; DMS (H) = 3,8; DMS (PE) = 4,6 |
||||
Médias seguidas de mesma letra minúscula na linha e maiúscula na coluna não diferem estatisticamente pelo teste de Tukey a 5% de probabilidade. H = hidratação. PE = período de estratificação.
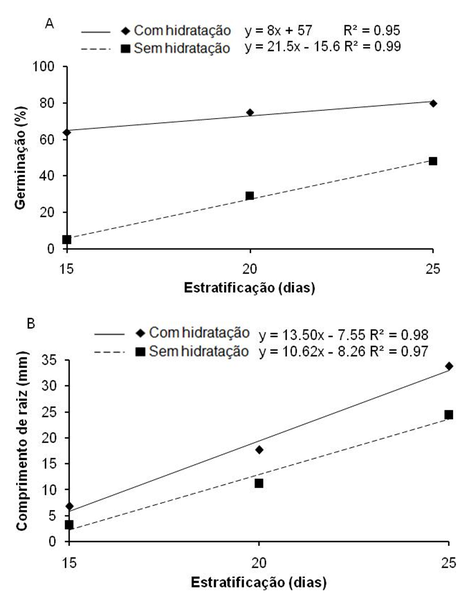
A análise de regressão para a porcentagem de sementes germinadas ao longo dos períodos de estratificação (Figura 2A) demonstra progressão nos valores percentuais de germinação, com reta de menor inclinação quando as sementes foram hidratadas, quando comparado ao tratamento sem hidratação. Tal fato revela menor diferença percentual entre os períodos de estratificação, especialmente entre 20 e 25 dias, o que também pode ser constatado na Tabela 1. Este comportamento indica que a hidratação das sementes antes ao período de estratificação, pode ter permitido avanço nas etapas da embebição, antecipando o processo de germinação para a maioria das sementes, explicando o maior percentual de sementes germinadas no tratamento com hidratação, já aos 15 dias (64%).
A “vantagem” propiciada pela antecipação do processo de embebição, nas sementes que passaram por hidratação antes da estratificação, deve ter influenciado o maior comprimento da raiz primária das plântulas (em relação ao tratamento sem hidratação), crescendo a medida que aumentou o período de estratificação (Figura 2B e Tabela 1). Para o fator hidratação não se observou diferença significativa na avaliação aos 15 dias de estratificação, com as maiores médias obtidas aos 20 e 25 dias em sementes hidratadas.
Figura 2
Porcentagem de germinação de sementes (A) e comprimento de raiz de plântulas
(B) de Annona mucosa Jacq. em função de tratamentos de hidratação e períodos
de estratificação e tratamentos. Função ajustada linear.
Significativo a 5% de probabilidade pelo teste de Tukey.
A estratificação de sementes de Carya illinoinensis (Wangenh.) K. Koch à temperatura de 4ºC por 60 dias, também resultou em plântulas com maior comprimento de raiz (POLLETO et al., 2016). A raiz é o órgão da planta responsável pela fixação, nutrição mineral e absorção de água (GONÇALVES, 2011), relacionada diretamente à sua sobrevivência. Desta forma, o maior comprimento de raiz promovido pelo tratamento hidratação + estratificação, pode favorecer o estabelecimento das plantas e a taxa de sobrevivência.
A hidratação das sementes como pré-tratamento germinativo promove a elevação dos teores de água da semente, provoca aumento de tamanho que rompe o tegumento e reativa processos metabólicos, desencadeando a retomada do crescimento do embrião (MARCOS FILHO, 2005) e promove superação da dormência fisiológica. A realização dessa metodologia em sementes de A. mucosa pode ter contribuído para redução do tempo de germinação, conforme indicação de Garner e Chaudhri (1976) para sementes de anonáceas por período de 24 horas previamente à semeadura. Além desse procedimento, estratificar as sementes também é alternativa para reduzir o tempo e padronizar a germinação.
A estratificação é método descrito para superação de dormência fisiológica ou embrionária de sementes (FOWLER e BIANCHETTI, 2000) que consiste em distribuir as sementes entre camadas de areia úmida, procedimento que propicia condições de temperatura, umidade e oxigênio favoráveis para maturação do embrião (CASTRO et al., 2012). Para as sementes de A. mucosa ela foi realizada em areia úmida e ambiente de viveiro sujeito a variação de temperatura ao longo do dia, condição que pode ter influenciado na superação da dormência e contribuído para a velocidade de germinação das sementes. Os resultados encontrados indicam que a espécie apresenta dormência embrionária, a qual não está relacionada na literatura para sementes de A. mucosa, porém já mencionada por Smet et al. (1999) como ocorrente na família Annonaceae e confirmada por Costa et al. (2011) para A. emarginata (Schltdl.) H. Rainer.
A combinação de período de hidratação + estratificação, demonstrou ser método eficaz para obtenção de elevada porcentagem de germinação de sementes de A. mucosa (> 80%), resultado superior ao obtido por Ferreira et al. (2009) para a mesma espécie (76% de germinação aos 69 dias da semeadura, utilizando a escarificação das sementes nos dois lados, seguida de embebição em água durante 24 horas), o que corrobora para demonstrar que a hidratação das sementes de A. mucosa contribui para favorecer seu processo germinativo. Hidratar as sementes permite reativação das funções metabólicas e a ativação do desenvolvimento embrionário (Marcos Filho, 2005) e a estratificação garante menor variação da temperatura diária, uniformiza a umidade do ambiente de germinação, evita o dessecamento das sementes, aumenta a tensão de gás carbônico e reduz a de oxigênio, resultando na maturação ou superação de bloqueios à germinação (CUNHA e FERREIRA, 1987). No entanto, tal processo deve ser avaliado para as sementes de cada espécie de Annonaceae. Para as sementes de A. squamosa não escarificadas, Wagner Junior (2006) concluiu que a embebição não contribuiu para favorecer a germinação, que após 71 dias atingiu apenas 33%.
Experimento 2: Observou-se interação significativa entre períodos de armazenamento e de estratificação, para as variáveis porcentagem de germinação e comprimento de raiz de A. mucosa (Tabela 2). A ampliação do período de estratificação em areia favoreceu o gradual aumento da porcentagem de germinação e do comprimento das raízes das plântulas, independentemente do tempo em que as sementes estiveram armazenadas.
As sementes não armazenadas apresentaram o menor percentual de germinação e de comprimento de raízes (Tabela 2 e Figura 3), demonstrando que logo após sua coleta deve ocorrer alguma condição que interfere no processo germinativo. Provavelmente imaturidade do embrião, condição que parece ser superada gradualmente com a permanência das sementes na estratificação em areia, com aumento percentual de 10 para 76% de germinação e de 9,5 para 18,8 cm de comprimento de raiz, respectivamente aos 15 e 25 dias de estratificação (Tabela 2). Este comportamento aparentemente tem analogia com a observação de Borghetti (2004) quanto à presença de embriões subdesenvolvidos e substâncias inibitórias da germinação para algumas espécies da família Annonaceae.
Tabela 2
Valores médios de % de germinação e comprimento de raiz de sementes de
Annona mucosa Jacq. submetidas a período de armazenamento e tempos de estratificação.
Armazenamento (dias) |
% de germinação |
|||||
Estratificação(dias) |
||||||
15 |
20 |
25 |
||||
0 |
10,0 |
cB |
58,0 |
bB |
76,0 |
aB |
30 |
67,0 |
bA |
70,0 |
bA |
77,0 |
aB |
60 |
65,0 |
bA |
68,0 |
bA |
87,0 |
aA |
C.V. (%) = 6,1; DMS (A) = 6,9; DMS (PE) = 6,8 |
||||||
Armazenamento (dias) |
Comprimento de raiz (mm) |
|||||
Estratificação (dias) |
||||||
15 |
20 |
25 |
||||
0 |
9,5 |
bC |
9,5 |
bC |
18,8 |
aC |
30 |
22,3 |
bA |
22,2 |
bA |
32,2 |
aB |
60 |
16,1 |
bB |
16,2 |
bB |
36,5 |
aA |
C.V. (%) = 10,3; DMS (A) = 3,6; DMS (PE) = 3,7 |
||||||
Médias seguidas de mesma letra minúscula na linha e maiúscula na coluna não diferem
estatisticamente pelo teste de Tukey a 5% de probabilidade.
A = períodos de armazenamento. TE = tempo de estratificação.
-----
Figura 3
Porcentagem de germinação e comprimento de raiz de sementes de
Annona mucosa Jacq. em função de tempos de estratificação. Função ajustada linear.
Significativo a 5% de probabilidade pelo teste de Tukey.

Os períodos de armazenagem das sementes parecem agir na superação do impedimento à germinação, com valores acima de 60% após 15 dias de estratificação, resultados superiores ao observado quando as sementes não foram armazenadas (10%) (Tabela 2). Ocorreu diferença significativa para o período de armazenamento das sementes aos 30 e 60 dias (77 e 87%, respectivamente) apenas quando foram estratificadas por 25 dias, contudo as médias de comprimento de raiz foram maiores quando as sementes permaneceram armazenadas por 30 dias e estratificadas por 15 e 20 dias. Estes resultados podem estar relacionados à expressiva redução do teor de água das sementes durante o armazenamento (Tabela 3), que após 60 dias da coleta (mesmo que hidratadas por 48 horas previamente a estratificação) tendem a levar mais tempo para atingir as fases do processo de embebição, o que explicaria o menor comprimento de raiz (Figura 3B) e o fato de, aos 25 dias de estratificação, as sementes armazenadas por 60 dias apresentarem maior percentual de germinação e de comprimento de raiz das plântulas, comportamento contrário ao observado entre os períodos de armazenamento com estratificação por 15 e 20 dias (Tabela 2).
Tabela 3
Grau de umidade das sementes de Annona mucosa Jacq.
após os períodos de armazenamento.
Armazenamento (dias) |
Grau de umidade (%) |
0 |
36,53 |
30 |
14,84 |
60 |
13,63 |
C.V.% = 2,4; DMS = 1,03 |
|
Apesar das sementes não armazenadas apresentarem menor percentual de germinação quando comparadas às sementes que foram armazenadas, se verifica pelas curvas de regressão que um período curto de estratificação (de 15 para 25 dias) foi suficiente para aproximar os valores percentuais de germinação (aumento 66%), mas não afetou o comprimento das raízes (Figura 3B). Isto pode ser explicado pela demora no início da emissão da raiz das sementes não armazenadas em relação às armazenadas, culminando em menores médias ao final do período de estratificação.
Pereira et al. (2011) estudando o armazenamento por 0, 7, 90 e 120 dias e a estratificação de sementes de Passiflora setácea DC, observaram que a estratificação em areia, a temperatura de 4ºC, resultou em aumento na emergência das plântulas em função do tempo de armazenamento, com maior porcentual de germinação aos 120 dias. Para A. squamosa L. os melhores resultados de germinação foram obtidos após armazenamento por seis meses em embalagem de papel em condições de ambiente, com temperatura média de 21ºC e umidade de 70% (MORAIS et al., 2009). Resultados que diferem dos encontrados por Souza (2005) para a mesma espécie após armazenamento por 0, 30 e 60 dias, não tendo observado superação de dormência das sementes. Tal relato contribui para o entendimento de que o período de armazenamento (de sementes com dormência embrionária) desempenha um papel importante no grau de dormência das sementes, influenciando na sua superação ou não. Dornelles et al. (2002), observaram aumento da porcentagem e velocidade de germinação de sementes de anonáceas armazenadas por até três meses, posterior estabilidade nas médias até seis meses e decréscimo ao final de um ano, justificando que o tempo de armazenamento, possivelmente foi o responsável pela superação da dormência. Deste modo, da mesma forma como descrito para A. squamosa e outras anonáceas, as sementes de A. mucosa não armazenadas apresentaram menor desempenho germinativo em comparação às sementes armazenadas.
Na Figura 4 se observa que durante a estratificação, as temperaturas mínimas e máximas registradas, variaram de 20,6 a 40,9oC no ambiente e de 20,0 a 33,0oC na areia, portanto a estratificação em areia permitiu redução expressiva da temperatura máxima registrada. As variações na temperatura, condicionaram também as variações na umidade, com valores entre 15 e 72% durante o período de avaliação (Figura 5).
Figura 4
Temperaturas (ºC) do ar e do substrato registradas ao longo do período de
estratificação de sementes de Annona mucosa Jacq. As setas indicam o fim
de cada período de estratificação.

-----
Figura 5
Umidade relativa do ar (%) registradas ao longo do período de estratificação de
sementes de Annona mucosa Jacq. As setas indicam o fim de cada período
de estratificação.

Ao longo do período de 25 dias de avaliação, registraram-se no ambiente e na areia menores temperaturas no período da manhã (M) e maiores temperaturas à tarde (T), com variações entre M/T de 9,3 a 19,9oC no ambiente e de 4,0 a 12oC na areia. As diferenças de temperatura entre a tarde e noite (N) foram menos intensas, com valores de 5,7 a 16,8oC no ambiente e de 1,0 a 8,0oC na areia. Assim, se observou que ocorreu em média, redução de cerca de 6,0 a 7,0oC na temperatura da areia em relação ao ambiente, entre os horários diários de avaliação.
Pelas condições registradas durante a estratificação, pode-se concluir que a alternância de temperaturas (mínima e máxima) registrada na areia, de 20-33oC durante a estratificação por 25 dias, é uma condição que favorece a germinação das sementes de A. mucosa. A variação da temperatura durante o período de germinação pode beneficiar espécies que possuem dormência, propiciando condições similares às ocorridas no ambiente (FOSSATI, 2007), por influenciar na disponibilidade das reservas e no desenvolvimento do embrião (SCALON et al., 2007). A temperatura média de germinação considerada ótima para a maioria das espécies arbóreas brasileiras é de 25ºC, para o Bioma Mata Atlântica, e 30ºC para a Amazônia (BRANCALION et al., 2010), locais de ocorrência natural de A. mucosa, portanto a média encontrada 26,3ºC está dentro da faixa descrita como ótima para germinação nestes biomas.
A alternância de temperatura durante a germinação de sementes também foi estudada em A. emarginata (Schltdl.) H. Rainer (COSTA et al., 2011) e A. squamosa L. (ZUCARELI et al., 2007), onde os melhores resultados foram obtidos com a alternância de temperatura de 20-30ºC (fotoperíodo de 8 e 16 h, respectivamente na menor e maior temperaturas), comportamento que pode estar ligado ao habitat de ocorrência dessas espécies, indicando adaptação fisiológica às condições do ambiente de origem.
Experimento 3: O tamanho das sementes não influenciou significativamente os resultados de porcentagem, velocidade e tempo médio de emergência e do índice de sincronização (TABELA 4), com médias de 82 e 93% de germinação, respectivamente, para sementes pequenas e grandes. Os resultados divergem do comportamento normalmente verificado na literatura, cuja variação no tamanho das sementes normalmente tem substancial influência sobre os resultados da germinação. Esse fato foi observado por Silva et al. (2010) para Artocarpus heterophyllus Lam., cuja porcentagem de germinação foi reduzida em sementes de menor tamanho apesar da velocidade não ter sido afetada pelo tamanho (pequena, média, grande e extragrande).
Tabela 4
Valores de emergência (EM), tempo médio de emergência (TME), índice de
velocidade de emergência (IVE) e índice de sincronização (Ē) de
Annona mucosa em função de diferentes tamanhos de sementes.
Tamanho das Sementes |
EMns (%) |
TMEns (dias) |
IVEns |
Ēns (bits) |
Pequenas |
82,0 |
28,87 |
0,76 |
0,99 |
Grandes |
93,0 |
26,13 |
0,93 |
0,88 |
C.V. (%) |
12,06 |
7,45 |
15,56 |
24,51 |
DMS |
18,26 |
3,55 |
0,23 |
0,40 |
ns – não significativo pelo teste F.
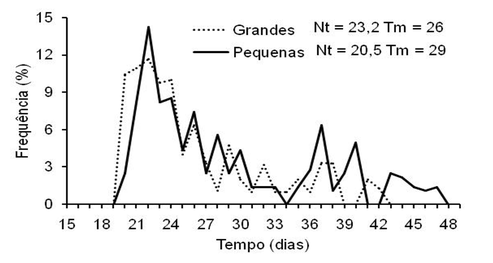
Na distribuição da frequência relativa da germinação (FIGURA 6) se observa para sementes grandes e pequenas, a distribuição apresentando polígonos polimodais entre 19 e 43 dias para sementes grandes (t = 26 dias) e entre 19 e 48 dias para sementes pequenas (t = 29 dias). Nestas últimas, ocorreu deslocamento do tempo à esquerda da moda ocorrendo aumento do tempo médio (t). A frequência relativa da germinação permite analisar a distribuição da germinação durante o período de avaliação do experimento, e a análise dos polígonos de frequência demonstra variância da germinação e da velocidade média, apesar do TME não ter sido significativo para os fatores estudados e as sementes, independentemente do tamanho, levarem em média 19 dias para germinar.
As dimensões das sementes de A. mucosa interferiram no vigor das plântulas, que quando originárias de estruturas maiores, apresentaram valores superiores de diâmetro do coleto, número de folhas, comprimento da parte aérea e raiz, massa seca aérea e de raiz, quando comparados as plântulas originárias de sementes menores (Tabela 5). Isso pode ser explicado pela maior quantidade de reserva a ser disponibilizada ao embrião originando plantas mais vigorosas (Carvalho e Nakagawa, 2012).
Figura 6
Frequência relativa de emergência de plântulas de Annona mucosa em função do
tamanho das sementes. A = sementes maiores. B = sementes menores.
Nt = número total de sementes germinadas, Tm = tempo médio de emergência.
------
Tabela 5
Valores de Diâmetro do coleto (DC), Número de folhas (NF), Comprimento aéreo (CA)
e de raiz (CR), Massa seca aérea (MSA) e de raiz (MSR) de plantas
Annona mucosa em função de diferentes tamanhos de sementes.
Tamanho das sementes |
Variáveis |
|||||||||||
DC**(mm) |
NF** |
CA**(mm) |
CR**(mm) |
MSA**(mg) |
MSR*(mg) |
|||||||
Pequenas |
2,51 |
B |
4,47 |
B |
83,76 |
A |
125,39 |
B |
0,09 |
B |
0,05 |
B |
Grandes |
2,80 |
A |
5,20 |
A |
114,29 |
B |
140,07 |
A |
0,11 |
A |
0,06 |
A |
C.V.(%) |
12,30 |
|
14,12 |
|
15,11 |
|
13,36 |
|
27,01 |
|
23,75 |
|
DMS |
0,15 |
|
0,30 |
|
6,66 |
|
7,89 |
|
0,01 |
|
0,006 |
|
Médias seguidas de mesma letra na coluna não diferem estatisticamente pelo teste de Tukey a 5% de probabilidade. * significativo a 5%; ** significativo a 1%.
A semente é a estrutura que abriga e nutre o embrião, sendo suas reservas responsáveis por garantir o fornecimento de nutrientes no início da germinação, como o tamanho da semente reflete na quantidade de reserva a ser disponibiliza nas fases iniciais de desenvolvimento da planta, sementes maiores propiciarão condições mais favoráveis para sua germinação e crescimento (BEZERRA et al., 2004) e plantas que apresentam bom desenvolvimento têm sua origem em semente que forneceu condições favoráveis para o crescimento do embrião e isso se reflete na velocidade e uniformidade da emissão da raiz, no diâmetro do coleto, número de folhas e quantidade de matéria fixada e interfere nas chances de sobrevivência da planta no campo (MUNIZZI et al., 2010).
Resultados semelhantes foram obtidos por Klein et al. (2007) quando estudaram o efeito do tamanho da semente na emergência e desenvolvimento inicial de mudas de Eugenia uniflora L. em substrato comercial Plantmax®, concluindo que sementes médias e grandes originaram plantas maiores para as variáveis comprimento do caule e raiz e número de folhas em relação às originadas de sementes pequenas.
De acordo com as condições em que foi realizado o trabalho, conclui-se que:
- O comportamento das sementes de Annona mucosa indica existência de dormência embrionária;
- A hidratação por 48 horas seguida de estratificação por 20 ou 25 dias é um método recomendado para superação de dormência de sementes de A. mucosa;
- O armazenamento das sementes por 30 ou 60 dias, em sacos de papel Kraft à temperatura ambiente, reduz a dormência embrionária;
- Sementes maiores (≥ 17mm de comprimento, 9 mm de largura e 7 mm de espessura) originam plântulas mais vigorosas, devendo ser preferencialmente utilizadas para produção de mudas.
BRANCALION, PHS; NOVEMBRE, ADdaLC; RODRIGUES, RR (2010). Temperatura ótima de germinação de sementes de espécies arbóreas brasileiras. Revista Brasileira de Sementes, Londrina, v.32, n.4, p.15-21.
BEZERRA, AME; MOMENTÉ, VG; MEDEIROS FILHO, S (2004). Germinação de sementes e desenvolvimento de plântulas de moringa (Moringa oleifera Lam.) em função do peso da semente e do tipo de substrato. Horticultura Brasileira, Brasília, v.22, n.2, p.295-299.
BORGHETTI, F (2004). Dormência embrionária. In: FERREIRA, A.G.; BORGHETTI, F. (Org.). Germinação: do básico ao aplicado. Porto Alegre: Artimed, p.109-123.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento (2009). Regras para análise de sementes. Secretaria de Defesa Agropecuária, MAPA/ACS, Brasília, 395p.
________ (1992). Ministério da Agricultura e Reforma Agrária. Secretaria de Defesa Agropecuária. Regras para análise de sementes. Brasília: SNDA/DNDV/CLAV, 365p.
CARVALHO, NM; NAKAGAWA, J (2012). Sementes: ciência, tecnologia e produção. 4.ed. Jaboticabal: FUNEP, 590p.
CASTRO, D; MELLO, RSP; POESTER, GC (2012). Práticas para restauração da mata ciliar. Porto Alegre: Catarse–Coletivo de Comunicação, 60p.
COSTA, PN; BUENO, SSC; FERREIRA, G (2011). Fases da germinação de sementes de Annona emarginata (SCHLTDL.) H. Rainer em diferentes temperaturas. Revista Brasileira de Fruticultura, Jaboticabal, v.33, n.1, p.253-260.
CUNHA, GG; FERREIRA, AG (1987). Viabilidade de sementes de erva-mate. Ciência e Cultura, São Paulo, v.39, n.10, p.974-976, 1987.
DE SOUZA BARBOZA, TJ et al (2015). Antimicrobial activity of Anonna mucosa (Jacq.) grown in vivo andobtainedby in vitroculture. Brazilian Journal of Microbiology, São Paulo, v.46, n.3, p.785-789.
DORNELLES, ALC; LIMA, AR; CAMPOS, VC (2002). Avaliação do potencial de armazenamento de sementes de Annona crassiflora Mart, Annona muricata L. e Annona squamosa L. Anais ..., Belém, Brasil. CD ROM.
FERREIRA, DF (2011). SISVAR: a computer statistical analysis system. Ciência e Agrotecnologia, Lavras, v.35, n.6, p.1039-1042.
FERREIRA, MGR et al (2007). Superação de dormência em sementes de biribá (Rollinia mucosa (Jacq) Baill). Porto Velho: Embrapa, 4p. (Circular Técnica, 94).
FERREIRA, MGR et al (2009). de L.A. Superação de dormência em sementes de biribá (Rollinia mucosa (Jacq.) Baill). Revista Brasileira de sementes, Londrina, v.31, n.4, p.95-99.
FLORIANO, EP (2004). Germinação e dormência de sementes florestais. Caderno Didático, Santa Rosa, 1.ed., n.2, 19p.
FOSSATI, LC (2007). Ecofisiologia da germinação das sementes em populações de Ocotea puberula (Rich.) Ness, Prunus sellowii Koehne e Piptocarpha angustifólia Dusén Ex Malme.176p. Tese (Doutorado em Ciências Florestais) – Universidade Federal do Paraná, Curitiba.
FOWLER, A.JP; BIANCHETTI, A (2000). Dormência em sementes florestais. Colombo: Embrapa Florestas, 27p. (Embrapa Florestas. Documentos, 40).
GARNER, RJ; CHAUDHRI, S (1976). A. Annona muricata: soursop, ecology and growth in relation to propagation of tropical fruits trees. Slough: CAB, 235p.
GONÇALVES, EG; LORENZI, H (2011). Morfologia Vegetal: Organografia e dicionário ilustrado de morfologia das plantas vasculares. 2.ed. São Paulo: Instituto Plantarum, 512p.
JULHO, MF (2005). Fisiologia de Sementes de plantas cultivadas. In: JULHO, M.F. Dormência de sementes. Piracicaba: FEALQ, p.253-287.
KAVATI, R; DONADIO, LC (2011). Biribá. Jaboticabal: Funep, 15p.
KLEIN, J et al (2007). Efeito do tamanho da semente na emergência e desenvolvimento inicial de mudas de pitangueira (Eugenia uniflora L.). Revista Brasileira de Biociências, Porto Alegre, v.5, n.2, p.861-863.
KRINSKI, D; MASSAROLI, A; MACHADO, M (2014). Potencial inseticida de plantas da família Annonaceae. Revista Brasileira de Fruticultura, Jaboticabal, v.36, ed. especial, p.224-243.
LABORIAU, LGA (1983). Germinação das sementes. OEA: Washington, 174p.
LABOURIAU, LG; PACHECO, A (1978). On the frequency of isothermal germination in seeds of Dolichos biflorus L. Plant and Cell Physiology, Tokyo, v.19, n.3, p.507-512.
LABOURIAU, LG; VALADARES, MEB (1976). On the germination of seeds Calotropis procera (Ait) Ait.f. Anais…, Rio de Janeiro, v.48, n.2, p.263-284.
LORENZI, H et al (2006). Frutas brasileiras e exóticas cultivadas. Nova Odessa: Instituto Plantarum de Estudos da Flora Ltda, 672p.
LULA, AA et al (2000). Estudos de agentes químicos na quebra de dormência de sementes de Paspalum paniculatum L. Revista Ciência Agrotecnica, Lavras, v.24, n.2, p.358–366.
MAGUIRE, JD (1962). Speed of germination aid in selection and evaluation for seedling emergence and vigor. Crop Science, Madison, v.2, n.2, p.176-177.
MARCOS FILHO, J (2005). Fisiologia de sementes de plantas cultivadas. Piracicaba: FEALQ, 495p.
MINUZZI, A et al (2010). Qualidade de sementes de quatro cultivares de soja, colhidas em dois locais no estado de Mato Grosso do Sul. Revista Brasileira de Sementes, Londrina, v.32, n.1, p.176-185.
MORAIS, OM et al (2009). Armazenamento de sementes de Annona squamosa L. Biotemas, Florianópolis, v.22, n.4, p.33-44.
NAKAGAWA, J (1999). Testes de vigor baseados no desempenho de plântulas. In: KRZYZANOWSKI, F.C; VIEIRA, R.D.; FRANÇA NETO, J.B. (ed.). Vigor de sementes: conceito e testes. Londrina: ABRATES. Cap.2, p.1-24.
PEREIRA, WVS et al (2011). Armazenamento de sementes de maracujazeiros. Pesquisa Agropecuária Tropical, Goiânia, v.41, n.2, p. 273-278.
POLETTO, T et al (2016). Superação de dormência e qualidade de mudas de Nogueira-pecã em viveiro. Ciência Rural, Santa Maria, v.46, n.11, p.1980-1985.
REHMAN, S et al (1996). The effect of sodium chloride on germination and the potassium and calcium contents of Acacia seeds. Seed Science and Technology, Zurich, v.25, p.45-57.
ROVERSI, T et al (2002). Superação de dormência em sementes de acácia negra (Acacia mearnsii Willd.). Revista Brasileira de Agrociência, Pelotas, v.8, n.2, p.161-163.
SANTOS, JG et al (2009).. Germinação e crescimento de mudas de biribazeiro (Rollinia mucosa (Jack.) Baill.) no Brasil. Idesia, Arica, v.27, n.2, p.55-59.
SCALON, SPQ et al (2007). Temperatura, luz e substrato na germinação de sementes de cipó-mil-homens (Aristolochia triangulares Cham. Et. Schl.). Revista Brasileira de Plantas Medicinais, Botucatu, v.9, n.4, p.32-38.
SILVA, KS et al (2010). Influência do tamanho da semente da germinação e vigor de mudas de jaqueira (Artocarpus heterophyllus Lam.). Revista Verde de Agroecologia e Desenvolvimento Sustentável, Mossoró, v.5, n.4, p.217-221.
SMET, S et al (1999). Seed structure and germination of cherimoya (Annona cherimola Mill.). Acta Horticulturae, Wageningen, n.497, p.269-278.
SOUSA, SA (2005). Cultura da Pinheira: caracterização de frutos, germinação e atributos de qualidade requeridos pelo sistema de comercialização. 70p. Dissertação (Mestrado em Ciências Agrárias) – Universidade Federal da Bahia, Cruz das Almas.
TAVARES, DVL et al (2015). Metodologia de quebra de dormência em sementes de sucupira-branca. Revista Conexão Eletrônica, Três Lagoas, v.12, n.1, p.01-09.
WAGNER JÚNIOR, A et al (2006). Influência do tempo de embebição em água sobre a dormência de sementes de pinha (Annona squamosa L.). Revista Ceres, Viçosa, v.53, n.307, p.317-32.
ZUCARELI, V et al (2007). Luz e temperatura na germinação de sementes de Annona squamosa L. Revista Brasileira de Biociências, Porto Alegre, v.5, supl.2, p.840-842.
1. M.Sc. em Biodiversidade e Agroecossistemas Amazônicos – PPGBioAgro, Universidade do Estado de Mato Grosso - UNEMAT, Campus Alta Floresta-MT. * Autor para correspondência: letqs@hotmail.com
2. Bióloga, Dr. docente PPGBioAgro - UNEMAT, Campus Alta Floresta-MT. 2 Autor para correspondência: luciabraga@unemat.br