

Vol. 38 (Nº 32) Año 2017. Pág. 21
AGUIAR, Diego Ribeiro de 1; GAMA João Ricardo Vasconcellos 2; BELDINI, Troy Patrick 3
Recibido: 11/02/2017 • Aprobado: 12/03/2017
RESUMO: Este trabalho teve como objetivo determinar os estoques de carbono em uma das unidades de trabalho (UT) da Cooperativa Mista da Flona Tapajós Verde (COOMFLONA) na Floresta Nacional do Tapajós (FNT) e analisar sua distribuição na estrutura vertical da floresta ombrofila densa e relacionar com o grupo ecológico das espécies. O estudo foi conduzido na Unidade de Produção Anual - 5 (UPA-5) da COOMFLONA, nas UTs 7 e 10, com cada UPA medindo 1.000m x1.000 m. Foram mensurados todos os indivíduos com diâmetro a altura do peito (DAP) ≥ 10 cm. Para a quantificação de biomassa foram empregadas quatro equações alométricas. Para as diferentes equações usadas na quantificação de biomassa a variação foi de 59,18 a 128,89 MgC.ha-1. Na análise dos grupos ecológicos verificou-se que as espécies TS representam 73,5% dos indivíduos do inventário e essas são mais representativas no acúmulo de carbono na estrutura da floresta. |
ABSTRACT: This study aimed to determine the carbon stocks in one of the work units (WU) of the Cooperative Flona Tapajós Verde (COOMFLONA) in the Tapajós National Forest (FNT) and to analyze its distribution in the vertical structure of the dense ombrophylous forest and to relate with the ecological group. The study was conducted at the Annual Production Unit - 5 (APU-5) of COOMFLONA, at WUs 7 and 10, with each APU measuring 1,000m x 1,000m. All individuals with diameter at breast height (DBH) ≥ 10 cm were measured. For the quantification of biomass the four allometric equations were used. For the different equations used in the quantification of biomass the variation was from 59.18 to 128.89 MgC.ha-1. Shadow-tolerant species represent 73.5% of the individuals in the inventory and these are more representative in the carbon accumulation in the forest structure. |
A vegetação da Amazônia tem demonstrado sua importância no controle das mudanças climáticas globais, tanto pela capacidade de emitir gases de efeito estufa para a atmosfera por meio da queima e desmatamento, quanto pela absorção de carbono da atmosfera pelo crescimento da floresta (SOUZA et al., 2012). Estudos mostram que a redução da extensão das florestas pode contribuir com aproximadamente 20% para o aumento da concentração atual de CO2 atmosférico (RAMANKUTTY et al., 2007).
Uma forma de quantificar o carbono é através de estimativas de biomassa arbórea, as quais são essenciais para determinar padrões geográficos nos estoques e magnitudes dos fluxos de carbono devido à mudança no uso da terra (FELDPAUSCH et al., 2012). Dessa forma, a floresta pode atuar como um sumidouro, porque as árvores absorvem carbono durante a fotossíntese e armazenam o excesso na forma de biomassa (HIGUCHI et al., 2004).
Questões relacionadas ao clima, áreas de manejo florestal, podem ser explicadas a partir de estimativas de biomassa florestal. A biomassa está relacionada aos estoques de nutrientes, fatores que são importantes para a dinâmica das florestas tropicais. No caso do clima, ele é usado para estimar o carbono durante o processo de queima (HIGUCHI et al., 1998).
As estimativas do armazenamento de carbono devem priorizar as medições de biomassa no campo porque são determinadas com maior exatidão e, portanto, garantem estimativas mais precisas das quantidades de carbono armazenado. É importante notar que o uso de modelos matemáticos é válido apenas para as condições a qual foi ajustado, pois os resultados podem variar entre diferentes tipos de ecossistemas (KOEHLER et al., 2005).
Modelos para quantificar o carbono podem melhorar estimativas de florestas tropicais para sequestro e emissão carbono ou nutrientes. A capacidade de estimar a idade e o crescimento de árvores tropicais exploradas comercialmente pode produzir informações úteis para o planejamento da freqüência de operações (VIEIRA et al., 2005).
Com isso, compreender as diferenças funcionais entre as muitas espécies de árvores coexistentes nas florestas tropicais é uma tarefa importante para a ecologia teórica e aplicada. As espécies podem ser agrupadas de acordo com o grupo taxonômico compartilhado e características morfológicas e fisiológicas que indicam estratégias de alocação de carbono e funções do ecossistema (KEELING et al., 2008). O conhecimento do comportamento ecológico de espécies arbóreas em florestas tropicais também contribui para a eficiência e aumento da qualidade do manejo florestal (GONÇALVES et al., 2010).
Com isso, este trabalho objetivou quantificar o carbono em duas unidades de trabalho (UT), antes da exploração florestal realizada pela Cooperativa Mista da Flona Tapajós Verde (COOMFLONA), na Floresta Nacional do Tapajós (FNT), analisando a distribuição de carbono na estrutura da floresta e nos grupos ecológicos.
A FNT está localizada no estado do Pará, ao longo da rodovia Cuiabá-Santarém (BR-163), na porção central da floresta amazônica. Está situado entre os paralelos 2 º 45 'e 4 º 10' S e os meridianos 54 º 45 'e 55 º 30' W, e inclui os municípios de Belterra, Aveiro, Rurópolis, abrangendo uma área de aproximadamente 545.000 ha . Administrado pelo Instituto Chico Mendes de Conservação da Biodiversidade (ICMBio), tem como objetivo básico o uso múltiplo de recursos florestais e a pesquisa científica, com ênfase nos métodos de manejo florestal (BRASIL, 2002).
O clima é tipo Ami (Köppen), com temperatura média anual de 25,5 ° C. A estação chuvosa ocorre entre janeiro e maio, resultando em uma precipitação média durante o ano de 1.820 mm. A FNT está localizado em um antigo, quase plano, planalto remanescente erosional formado em sedimentos da formação de obstáculos, e o relevo local da área de estudo é ligeiramente ondulado. O solo predominante na área de estudo é um Latossolo distrófico, e a vegetação é classificada como floresta tropical, caracterizada pela dominância de grandes árvores individuais (GONCALVES e SANTOS, 2008).
Este estudo foi realizado na UPA-5 (Unidade de Produção Anual), da COOMFLONA, especificamente nas unidades de trabalho (UT) 7:10, medindo 1.000 x 1.000 m (100 ha) cada uma localizada no km 83. Dentro dessas unidades de trabalho 36 Sub-parcelas de 20m x 250m (18 sub-parcelas em cada UT) foram instaladas por meio de amostragem sistemática. Medindo-se o diâmetro de todas as árvores à 1,30 m do solo (DAP) ≥ 10 cm.
Estimativas de coeficiente de variação e erro de amostragem são importantes para determinar quão preciso é o inventário (KELLER et al., 2001). A estatística do inventário florestal foi calculada por meio da amostragem casual estratificada. As fórmulas utilizadas tendo como variável a biomassa, foram aplicadas de acordo com Soares et al. (2006) descritas a seguir:

As espécies foram agrupadas em clímax exigentes de luz (CL) e tolerante à sombra (TS) de acordo com o trabalho de Carvalho (1992). Para análise da composição florística foram calculados índices de diversidade e similaridade e distribuição espacial. A diversidade foi calculada usando Shannon e Weaver (H '), Equability Pielou (J) e quociente de Mistura de Jentsch (QM). Os parâmetros fitossociológicos foram calculados de acordo com o trabalho de Finol (1971).
Os modelos utilizados para estimativa de biomassa estão relacionados na Tabela 1.
Tabela 1 – Modelos utilizados para o cálculo de biomassa fresca (Kg), Floresta Nacional do Tapajós, Santarém, Pará.
Table 1 - Models used for the calculation of fresh biomass (Kg),
Tapajós National Forest, Santarém, Pará.
Modelos |
Parâmetros |
Referências |
|||
a |
b |
c |
|||
1 |
M = a + b ln (DAP) + ɛ |
-2.025 |
2.459 |
- |
Lima et al. (2012) |
2 |
M = a + b ln (DAP)] + ɛ |
-1.716 |
2.413 |
- |
Nogueira et al. (2008) |
3 |
M = a*(DAP)b + ɛ |
2.273 |
1.915 |
- |
Silva (2007) |
4 |
M = a(b DAP c) + ɛ |
0,6 |
4,06 |
1,76 |
Araújo et al., (1999) |
M = biomassa fresca, DAP = diâmetro em cm a 1,3 m de altura do solo.
Para a escolha da equação a ser utilizada na quantificação de biomassa na área de estudo, foi realizada a Análise de Variância (ANOVA One-Way) utilizando o teste de comparação de média Tukey com 5% de significância. Os parâmetros fitossociológicos e os cálculos de biomassa foram realizados no LibreOficce Calc e as análises estatísticas com o software R studio 3.3.2.
O inventário florestal registrou 234 espécies, pertencentes a 50 famílias botânicas. Famílias com maior riqueza de espécies foram Fabaceae (60), Sapotaceae (24), Moraceae (15) e Lauraceae (14). Essas famílias representam 36,3% dos indivíduos amostrados. Considerando indivíduos com DAP≥10 cm, estimou-se 343 ind.ha-1 e 21,51 m2.ha-1 área basal.
No Projeto de Assentamento Moju I e II, distante aproximadamente 70 km da área de estudo, Vieira et. al (2015) - inventariando árvores com DAP ≥ 10 cm - registraram 252 espécies em 44 parcelas de 0,98 ha a 1,0 ha (amostra de 43,52 ha) - distribuídas em floresta manejada e não manejada, nas comunidades de Santo Antônio e São Mateus, com valores médios de 384 árv.ha-1 e 24,19 m2.ha-1 de área basal. Estes autores também verificaram que as famílias Fabaceae e Sapotaceae são as que apresentam o maior número de espécies em floresta manejada e não manejada ao longo da BR-163 entre os municípios de Santarém e Placas (PA).
Este inventário conduzido na FNT, mostrou que das 234 espécies, 55,56 % das espécies são TS e 44,44 % são CL, o que mostra um predomínio de espécies tolerantes à sombra na floresta tropical. Considerando que a maior parte das espécies são tolerantes a sombra, confirma-se que o desenvolvimento da floresta está em estágio clímax.
A amostra obteve um erro de 9,31%, para a variável biomassa, dentro dos parâmetros que requerem um erro menor que 10% e o coeficiente de variação foi de 27,65% (IBAMA, 2007).. Isso coloca o inventário dentro de limites de erro aceitáveis, que obtiveram resultados satisfatórios para o sistema de amostragem utilizado neste estudo.
O valor obtido para o Shannon-Weaver (H '= 4,53) mostrou alta diversidade (H'> 3,5) e foi consistente com os valores encontrados para Gonçalves e Santos (2008) em FNT. A razão de mistura (QM) expressou Jentsch de 12 indivíduos de cada espécie na área de estudo (QM = 1:12), o que significa que existe uma grande diversidade de espécies na área. De acordo com Finol (1975), o QM das florestas tropicais naturais seria de aproximadamente nove indivíduos por espécie, indicando alta heterogeneidade. O índice de Equabilidade de Pielou (J) indicou que 83% da diversidade máxima foi representada no inventário florestal. Valores semelhantes foram estimados por Andrade et al. (2015) inventariando árvores com DAP≥10 cm em uma área de 79.000 ha na FNT, a saber: 227 espécies, alta diversidade de espécies (H' > 4,4), 82% da diversidade máxima (J) contemplada na amostragem.
A distribuição da classe de diâmetro tem estrutura de curva J-reverso, uma estrutura típica de floresta inequiâneas (REIS et al., 2014), e indica que o processo regenerativo está funcionando na área (Figura 1). As florestas tropicais sem grande perturbação tem distribuição diamétrica na forma de J-reverso, caracterizando uma comunidade típica, autorregenerante, onde o maior número de indivíduos está nas menores classes de diâmetro (HESS et al., 2010).
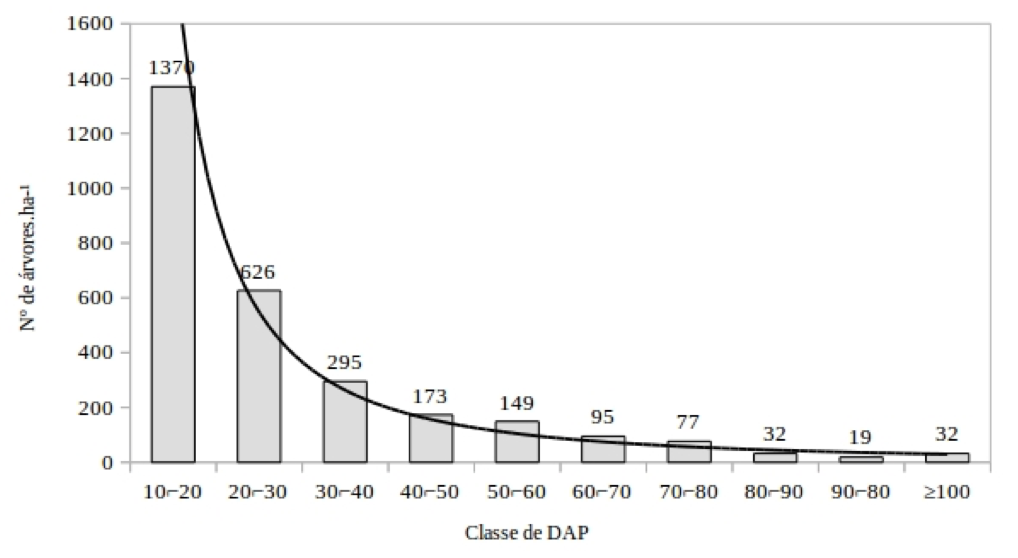
Figura 1 – Distribuição diamétrica para as árvores inventariadas, Floresta Nacional do Tapajós, Santarém, Para.
Figure 1 - Diameter distribution for DBH classes of individuals inventoried, Tapajos National Forest, Santarém, Para.
O trabalho de campo focado em medidas de inventário florestal e estimativas diretas de biomassa através de métodos destrutivos poderia melhorar a quantificação de estoques de carbono nesta floresta. As medidas de diâmetro à altura do peito (DAP) sozinhas ou combinadas com a altura das árvores foram convertidas para estimativas de estoques de carbono em florestas usando relações alométricas. A biomassa pode ser convertida em teor de carbono com referência à metade do peso da biomassa (GIBBS et al., 2007). Os valores de biomassa fresca foram multiplicados por 0,584 para obtenção da biomassa seca e 0,485 para o teor de carbono (SILVA, 2007; HIGUCHI et al., 2009). As estimativas de biomassa obtidas a partir de equações alométricas são mostradas na Tabela 2.
Tabela 2 - Estoque de biomassa e carbono estimados, em Mg.ha-1, das equações utilizadas, Floresta Nacional do Tapajós, Santarém, Pará.
Table 2 - Estimated biomass and carbon stock, in Mg.ha-1, of the equations used, Tapajós National Forest, Santarém, Pará.
Modelos |
1 |
2 |
3 |
4 |
Biomassa fresca (Mg.ha-1) |
173,53 |
197,48 |
377,91 |
229,01 |
Biomassa seca (Mg.ha-1) |
101,34 |
115,33 |
220,70 |
133,74 |
Carbono (Mg.ha-1) |
59,18 |
67,35 |
128,89 |
78,11 |
A biomassa fresca dos modelos variou entre 173,53 a 377,91 Mg.ha-1. No trabalho de Veira et al. (2004), para árvores com o DAP≥10 cm em que a biomassa fresca foi de 360,00 Mg.ha-1, em Manaus, 190,00 Mg.ha-1 em Rio Branco e 281,00 Mg.ha-1, para Santarém. Em uma área manejo florestal em Mato Grosso, a quantidade de biomassa fresca foi de 276,12 Mg.ha-1 (FELDPAUSCH et al., 2005).
Estudos realizados em cinco áreas diferentes na Venezuela, concluíram que o carbono armazenado na biomassa acima do solo para árvores maiores que 10 cm de DAP variam de 70 MgC.ha-1 em áreas de floresta seca e até 179 MgC.ha-1 em áreas de floresta com alta umidade (DELANEY et al., 1997). Para as quatro equações utilizadas para estimativa de carbono, o intervalo foi de 59,18 a 128,89 MgC.ha-1.
Em florestas muito secas, a biomassa e carbono de árvores com diâmetro menor que 10 cm está entre 0,7 a 1,0 MgC.ha-1 ou 1,5% do carbono contido em árvores maiores que 10 cm de diâmetro (DELANEY et al., 1997). O estoque de carbono para o ano de 2010 no trabalho de Souza et al. (2012) foi 181,01 MgC.ha-1 para uma floresta tropical densa floresta úmida em Manaus / AM. No Pará existe um regime sazonal, que pode influenciar no teor de carbono da floresta, algo que justifica os valores obtidos a partir dos modelos testados.
O material vegetal seco contém carbono fixo suficiente para constituir o esqueleto das substâncias orgânicas de todas as células que é obtido a partir da fixação de dióxido de carbono por plantas (GOUDRIAAN, 1992). Este carbono fixo na estrutura de cada árvore é assimilado ao estoque ao longo do processo de desenvolvimento de espécies presentes na estrutura florestal, que também e pode ser usado como parâmetro para espécies ecológicas.
A estimativa precisa da biomassa em florestas tropicais é crucial para muitas aplicações, desde a exploração comercial da madeira até o ciclo global do carbono. Particularmente neste último contexto, a estimativa da biomassa aérea acima do solo deve ter precisão suficiente para poder descrever aumentos ou diminuições de carbono armazenado na floresta em períodos relativamente curtos (2-10 anos), o que é cada vez mais importante (BASUKI et al., 2009). O uso de estimativas de biomassa pode ajudar a mensurar o estoque de carbono e também auxiliar na avaliação do efeito causado pela atividade florestal.
Atividades antrópicas influenciam nas concentrações atmosféricas de CO2 através dos efeitos de mudança no uso da terra e atividades de manejo florestal na reserva de carbono e biomassa terrestre (BEETS et al., 2012). Dessa forma, o efeito de exploração no estoque de carbono da floresta está relacionado a a intensidade de retirada de madeira e a forma como é planejado.
As quatro equações testadas foram submetidos a uma a análise de variância, onde os valores de carbono estimados diferiram significativamente (F=239,3, p < 2E-16), o teste de Tukey indicou que todas as equações (p<0.05) tiveram diferença significativa. Dessa forma, a equação escolhida foi a 4 por ter sido ajustada no estado do Pará (Figura 2).
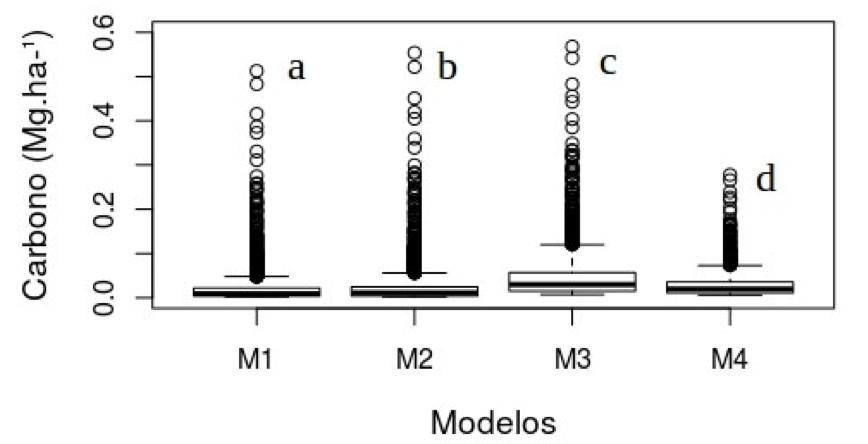
Figura 2 – Distribuição de carbono para as equações utilizadas, as letras diferentes correspondem
a diferença significativa do teste Tukey a 0,05, Floresta Nacional do Tapajós, Santarém, Pará.
Figure 2 - Distribution of carbon for the equations used, different letters correspond significant difference
the Tukey test a probability level of 0.05, National Forest of Tapajós, Santarém, Pará.
A alocação de carbono predomina nas classes de tamanho inferiores (Figura 3). A distribuição de carbono para os grupos ecológicos, revela um predomínio das espécies TS em toda a estrutura horizontal. Os valores correspondem a 73,5% para as espécies TS, enquanto 26,5% são CL. Esse maior percentual deve estar relacionado a estrategia de desenvolvimento de maior parte das espécies, que estão a espera de melhores condições para atingirem estratos superiores.
Nas florestas tropicais, a competição de espécies tem recebido muita atenção da perspectiva de espécies TS versus espécies que necessitam de lacunas, isoladas em um único local, com pouca atenção dada à forma como a competição entre espécies TS pode mudar ao longo de um gradiente de luz (BRENES-ARGUEDAS et al., 2010). Estudos sobre algumas espécies sucessionais tardia e generalistas mostraram que o estabelecimento de árvores ocorrem em pequenas clareiras e com espécies sucessionais precoces sob o dossel. As espécies TS também podem beneficiar as mudanças naturais, efeitos de borda e impactos antrópicos (FLORES et al., 2006).
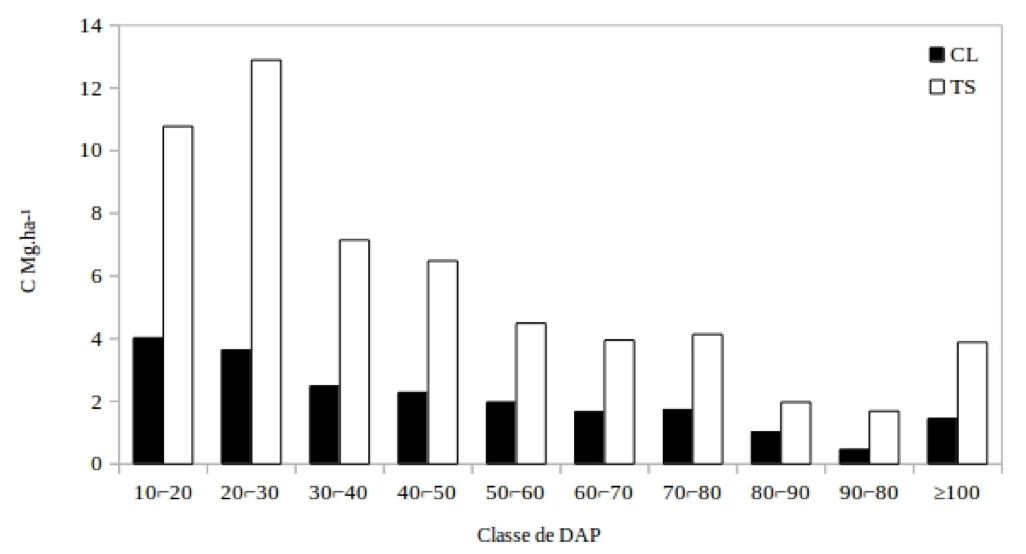
Figura 3 - Distribuição da biomassa na estrutura horizontal com intervalo de classe para a equação 4.
Figure 3 - Distribution of biomass in the horizontal structure with class interval for equation 4
Para as TS o intervalo de classe de tamanho de 10⌐50 cm concentra maior parte do carbono (37,30 MgC.ha-1), enquanto as com o DAP ≥ 50 cm, 20,13 MgC.ha-1. Essa tendência se repete para o grupo CL, no qual os indivíduos de DAP 10⌐50 cm tem quantidade superior, com 12,42 MgC.ha-1, comparado as classes de DAP ≥ 50 cm, que corresponde a 8,26 MgC.ha-1. Dessa forma, a maior concentração de carbono nas classes inferiores se justifica pelo maior número de indivíduos, levando em conta o modelo utilizado para a estimativa de biomassa. Em uma floresta a distribuição em J-invertido leva a uma inferência de um equilíbrio no estoque de espécies florestais, e essas espécies TS podem ser responsáveis por um equilíbrio dinâmico na floresta tropical densa.
O crescimento e a sobrevivência em condição de sombra implicam em aproveitar de forma satisfatória a pouca quantidade de luz que chega até as folhas, envolvendo adaptações morfológicas e fisiológicas (POORTER, 1999). De acordo com a hipótese do ganho de carbono (GIVNISH, 1988), toda a característica que melhore a eficiência do uso da luz, e dessa forma, gere um acréscimo no ganho de carbono, tende a estar presente nas espécies TS (VALLADARES e NIINEMETS 2008).
As espécies TS geralmente germinam sob a copa, e algumas permanecem durante toda a sua vida reprodutiva nesta condição, enquanto outras esperam a oportunidade de alcançar a superior do dossel e somente então se reproduzem (WHITMORE, 1998; COSTA et al., 2007). Ao analisar a distribuição de carbono na estrutura horizontal as maiores quantidades de biomassa se concentram nas classes inferiores, com a mesma característica de J-invertido da distribuição diamétrica.
Espécies desse grupo ecológico têm um elevado nível de sobrevivência das mudas no banco de sementes e a tolerância das espécies na sombra provavelmente tem um forte efeito sobre a sobrevivência e pode ter uma relação entre a abundância das espécies e as taxas de sobrevivência das mudas ao nível de comunidade (COMITA e HUBBELL, 2009).
A posição ocupada em cada estrato individual com diferentes espécies pode ser interpretada como uma característica da idade, e os adultos ocupam os níveis mais altos, enquanto os caules jovens ocupam os estratos inferiores. No entanto, esta declaração não deve ser aceita em todos os casos, uma vez que é perfeitamente possível que o rápido crescimento de espécies oportunistas possa rapidamente levá-los para o dossel da floresta e, em vez disso, as espécies muito TS, permanecem como vegetação de baixa estatura. Esta distinção de idade pode ser estendida até mesmo entre indivíduos da mesma espécie, dependendo da presença de melhores condições de luz para alcançar um crescimento mais rápido para atingir os níveis mais altos (FINOL, 1969). A Tabela 4 mostra as espécies que estão entre as que possuem maior estoque de carbono e seus respectivos grupo ecológico.
Tabela 4 – Espécies com maiores níveis de carbono no inventário, com espécie; família; grupo ecológico (EC):
clímax tolerante a sombra (TS), clímax exigente de luz (CL); Carbono (Mg.ha-1).
Table 4 - Species with greatest carbon in the inventory, with species, family, ecological group (EG):
shade tolerant (ST), light demanding (LD), Carbon (Mg.ha-1).
Espécies |
Família |
GE |
C (Mg.ha-1) |
Pouteria guianensis Aubl. |
Sapotaceae |
TS |
5,28 |
Couratari oblongifolia |
Lecythidaceae |
TS |
3,05 |
Eschweilera parviflora (Aubl.) Miers |
Lecythidaceae |
TS |
2,79 |
Rinorea guianensis Aubl. |
Violaceae |
TS |
2,69 |
Manilkara huberi ducke |
Sapotaceae |
TS |
2,66 |
Eschweilera odorata (Poepp) Miers. |
Lecythidaceae |
TS |
2,43 |
Carapa guianensis Aubl., |
Meliaceae |
TS |
2,11 |
Lecythis idatimon Aubl. |
Lecythidaceae |
TS |
1,83 |
Ocotea neesiana (Miq) Kosterm |
Lauraceae |
TS |
1,71 |
Eschweilera amazonica R.Knuth |
Lecythidaceae |
TS |
1,70 |
A família Lecythidaceae predomina entre as espécies com maior quantidade de carbono na área inventariada, algo que reflete a importância desses indivíduos para a fixação de CO2 na FNT. Assim como, o grupo ecológico TS é de maior destaque entre as espécies de maior biomassa e por estarem em maior número comprovam a eficiência na estratégia de desenvolvimento.
Espécies de diferentes famílias podem possuir morfologias similares, enquanto que espécies do mesmo gênero podem apresentar características morfológicas distintas (BOEGER et al. 2004). Isso justifica diferentes famílias concentrarem maior parte do carbono e serem do mesmo grupo ecológico. Espécies TS investem mais em características relacionadas com a otimização da fotossíntese (POORTER, 1999; DUZ, 2004). A fase madura depende diretamente da capacidade de recrutar as espécies TS. Na sucessão de espécies invasoras, a maturação lenta tende a beneficiar as espécies climáticas TS, que são os principais responsáveis neste tipo de ocupação (CHAVE, 1999).
A Manilkara huberi duckefoi a quinta espécie com maior nível de carbono e também é bastante comercializada no mercado interno e externo. No trabalho com essa espécie em uma área no pós-exploratório Flona Tapajós, observou-se que esta espécie se beneficia da abertura do dossel, o que aumenta o grau de iluminação de copa (COSTA et al., 2007). Isto é devido à exposição à luz do dossel tem uma forte correlação com a taxa de crescimento. As árvores com copas totalmente expostas à radiação solar crescem significativamente mais rapidamente do que aquelas parcialmente ou completamente sombreadas, independentemente do grupo ecológico (SILVA et al., 2001).
Korning e Balslev (1994) avaliaram 22 espécies arbóreas na Amazônia (Equador) e identificaram cinco espécies com estratégia similar à apresentada por Manilkara huberi. Essas espécies preferiam a sub-dossel ou a copa, e eram TS, mas responderam oportunisticamente em termos de crescimento e melhorias nas condições de iluminação. Assim, as espécies climáticas TS com grandes quantidades de biomassa podem usar a mesma estratégia nos níveis mais altos da copa.
Na análise fitossociológica (Tabela 5), observa-se que apenas duas das 10 espécies com maiores níveis de carbono estão entre as 15 mais importantes. A espécie Manilkara huberi, apesar de ser a quinta espécie com maior biomassa, não está entre as 15 mais importantes devido à presença de indivíduos com alta dominância, mas em menor número. Quando o grupo ecológico é analisado, sete espécies são TS e oito CL .
Tabela 5 - Relação das espécies arbóreas mais importantes fitossociológicamente: densidade absoluta (DA);
freqüência absoluta (FA); dominância em m².ha-1 (Dom); índice do valor de importância relativo (VI)
e o grupo ecológico (GE): clímax tolerante a sombra (TS), clímax exigente de luz (CL).
Table 5 - List of most important phytosociological tree species: absolute density (DA), absolute frequency (FA),
dominance m².ha-1 (Dom) index of relative importance value (VI%) and ecological group (GE):
shade tolerant (TS), light demanding (CL).
Espécies |
DA |
FA |
Dom |
VI(%) |
GE |
Pouteria guianensis Aubl. |
11,89 |
5,94 |
6,81 |
7,60 |
TS |
Rinorea guianensis Aubl. |
7,94 |
3,97 |
5,17 |
5,31 |
TS |
Enterolobium maximum Ducke |
0,11 |
2,69 |
3,94 |
2,67 |
CL |
Enterolobium schomburgkii (Benth.) |
0,11 |
2,39 |
2,57 |
2,01 |
CL |
Eugenia uniflora L. |
0,17 |
2,31 |
2,48 |
1,95 |
CL |
Cecropia sciadophylla Mart. |
0,28 |
1,94 |
2,02 |
1,65 |
CL |
Bertholletia excelsa H.B.K |
0,61 |
1,78 |
1,92 |
1,61 |
CL |
Pausandra densiflora Lanj. |
1,06 |
1,69 |
1,68 |
1,57 |
TS |
Licania densiflora Kleinh. |
0,17 |
1,64 |
2,19 |
1,56 |
TS |
Sapium sceleratum Ridley |
0,11 |
1,83 |
2,01 |
1,56 |
TS |
Parkia multijuga Benth |
0,78 |
1,25 |
1,86 |
1,40 |
CL |
Maquira sp. |
0,28 |
1,50 |
1,78 |
1,37 |
TS |
Sclerolobium melanocarpum Ducke |
0,06 |
1,69 |
1,65 |
1,35 |
CL |
Cordia goeldiana Huber |
0,06 |
1,69 |
1,62 |
1,35 |
CL |
Minquartia guianensis Aubl. |
1,17 |
1,44 |
1,24 |
1,33 |
TS |
Subtotal |
24,78 |
33,78 |
38,95 |
34,30 |
|
Outras espécies |
134,56 |
45,89 |
47,68 |
65,70 |
|
Total |
159,33 |
79,67 |
86,63 |
100,00 |
|
As espécies florestais, relação à intensidade de luz, possuem comportamentos diferentes, o que contribui para a definição de suas características sucessionais (DANIEL et al., 1994). A sucessão tardia começam na sombra da floresta e crescem com as condições de exposição de copa da floresta a grandes mudanças ontogenéticas na disponibilidade de luz e devem ter uma grande capacidade de resposta plástica. Algumas espécies têm maior plasticidade em comparação com espécies que sempre permaneceram no sub-bosque, ou espécies pioneiras que sempre permaneceram em condições de altas luminosidade (ROZENDAAL et al., 2006).
As espécies climáticas TS, recebem um nível de iluminação intermitente têm uma baixa taxa de respiração e fotossíntese, em comparação com a luz exigindo espécies climax com mais flexibilidade para responder às mudanças nas condições de luz. Em particular, o seu crescimento é semelhante às espécies climáticas TS em pequenas clareiras, mas o seu crescimento é, de facto, maior em grandes clareiras (WHITMORE, 1998).
A floresta contêm diferentes níveis de alocação de carbono. Assim, saber o estoque das espécies, e a qual grupo ecológico pertencem, é importante para projetar uma taxa de emissão a partir das espécies comerciais durante a exploração florestal e ciclos de corte futuros, com base na estratégia ecológica de cada espécie. Entre as espécies comerciais com maior estoque de carbono por hectare estão a Pouteria guianensis Aubl., Couratari oblongifolia, Manilkara huberi ducke.
Com a predominância de espécies TS, na retenção de carbono é possível inferir, que estas são responsáveis pela maior parte da estruturação e serviço ambiental da floresta. Essas informações poderão auxiliar a COOMFLONA no desenvolvimento do manejo florestal, assim como, nas explorações futuras na FNT.
Andrade, D.F.C., Gama, J.R.V., Melo, L.O., Ruschel, A.R. (2015) Inventário florestal de grandes áreas na Floresta Nacional do Tapajós, Pará, Amazônia, Brasil. Biota Amazônia, v. 5, n. 1, p. 109-115.
APG III. Angiosperm Phylogeny Group. An update of the angiosperm Phylogeny group classification for the orders and families of flowering plants: APG III. Botanical Journal of the Linnean Society, v.161, p.105-121, 2009.
Araújo, T. M., Higuchi, N., Carvalho Jr, J. A. (1999) Comparison of formulae for biomass content determination in a tropical rain forest site in the state of Para, Brazil. Forest Ecology and Management 117, p. 43-52.
Basuki, T. M., Van Laake, P. E., Skidmore, A. K., Hussin Y.A. (2009) Allometric equations for estimating the above-ground biomass in tropical lowland Dipterocarp forests. Forest Ecology and Management, 257, p. 1684–1694.
Beets, P. N., Kimberley, M. O., Oliver, G. R., Pearce, S. H., Graham, J. D., Brandon, A. (2012) Allometric Equations for Estimating Carbon Stocks in Natural Forest in New Zealand. Forests, 3, 818-839. doi:10.3390/f3030818.
Boeger, M.R.T., Alves, L.C., Negrelle, R.R.B. (2004) Leaf morphology of 89 tree species from a lowland tropical rain forest (Atlantic forest) in South Brazil. Brazilian Archives of Biology and Technology, 47 (6): 933-943.
Brasil. 2002. Lei n. 9.985, de 18 de Junho de 2000: Sistema Nacional de Unidades de Conservação da Natureza (SNUC). 2.ed. MMA, Brasília, Distrito Federal. 52pp.
Brenes-Arguedas, T., Roddy, A. B., Coley, P. D., Kursar, T. A. (2010) Do differences in understory light contribute to species distributions along a tropical rainfall gradient? Community ecology, Acta Oecologia, n. 2, v. 166, p. 443-456.
Carvalho, J. O. P. (1992) Structure and dynamics of a logged over Brazilian Amazonian rain forest. 1992. 215 f. Thesis (Doctorate in Forestry Science) - University of Oxford, Oxford.
Chave, J. (1999) Study of structural, successional and spatial patterns in tropical rain forests using TROLL, a spatially explicit forest model. Ecological Modelling, n. 124 p. 233–254.
Comita, L. S., Hubbell, S. P. (2009) Local neighborhood and species’ shade tolerance influence survival in a diverse seedling bank. Ecology, n. 2, v. 90, p. 328–334.
Costa, D. H. M., Carvalho, J. O. P., Berg, E. V. D. (Jul./Dez, 2007) Crescimento diamétrico de maçaranduba (Manilkara huberi chevalier) após a colheita da madeira. Amazônia: Ciência e Desenvolvimento, Belém, v. 3, n. 5.
Daniel, O. Ohashi, S. T., Santos, R. A. (1994) Produção de mudas de Goupia glabra (Cupiúba): efeito de níveis de sombreamento e tamanho de embalagens. Revista Árvore, Viçosa,MG, v. 18, n. 1, p. 1-13.
Delaney, M., Brown, S., Lugo, A. E., Torres-Lezama, A. (1997) The distribution of organic carbon in major components of Forestlocated in five zones of Venezuela. Journal of Tropical Ecology, v. 13, p. 697-708.
DOI:https://doi.org/10.1017/S0266467400010877
Duz, S.R., Siminski, A., Santos, M., Paulilo, M.T.S. Crescimento inicial de três espécies arbóreas da Floresta Atlântica em resposta à variação na quantidade de luz. Revista Brasileira de Botânica 27: 587-596, 2004.
Finol, U. H.. (1975) La silvicultura em La Orinoquia Venezolana. Revista Forestal Venezolana, v.18, n. 25, p. 37-114.
Feldpausch, T. R., Jirka, S., Passos, C. A. M., Jasper, F., Riha S. J. (2005) When big trees fall: damage and carbon export by reduced impac logging in southern Amazonia. Forest Ecology and Management 219:199–215.
Feldpausch, T. R. Lloyd, J., Lewis, S. L., Brienen, R. J. W., Gloor, M., Mendoza, A. M., Lopez-Gonzalez, G., Banin, L., Abu Salim, K., Affum-Baffoe K., Alexiades, M., Almeida, S., Amaral, I., Andrade, A., Aragão, L. E. O. C., Murakami, A. A.. et al. (2012) Tree heigh t integrated into pantropical forest biomass estimates. Biogeosciences, 9, 3381–3403.
Finol, U. H. (1971) Nuevos parametros a considerarse en el analisis estructural de las selvas virgines tropicales. Revista Forestal Venezolana, Merida, v.14, n.21, p.29-42.
Finol, U. H.. (1969) Possibilidades de manejo silvicultural para las reservas forestales de la región occidental. Revista Forestal Venezolana, Merida, v.12, n.17, p.81-107.
Flores, O., Gourlet-Fleury, S., Picard, N. (2006) Local disturbance, forest structure and dispersal effects on sapling distribution of light-demanding and shade-tolerant species in a French Guianian forest. Acta oecology, v. 29, n. 2, p. 141-154.
Gibbs, H. K., Brown, S., Niles, J. O., Foley, J. A. (2007) Monitoring and estimating tropical forest carbon stocks: making REDD a reality. Environmental Research Letters, 2.
Givnish, T. J. (1988) Adaptation to sun and shade: a whole-plant perspective. Australian Journal of Plant Physiology v.15, p.63–92.
Goudriaan, J.. (1992) Adónde va el gás carbônico?: el papel da la vegetación. Mundo Científico, v. 126, n. 12, p. 687-692.
Gonçalves, F. G., Santos, J. R.. (2008) Composição florística e estrutura de uma unidade de manejo florestal sustentável na Floresta Nacional do Tapajós, Pará. Revista Acta Amazônica, vol. 38, p. 229 – 244.
Gonçalves D. A., Schwartz G., Pokorny B., Eldik T. V. (Jan./Mar. 2010) O uso da classificação de copa de dawkins como indicador do comportamento ecológico de espécies arbóreas tropicais. Floresta, Curitiba, PR, v. 40, n. 1, p. 175-182.
Hess, A. F., Calgarotto, A. R., Pinheiro, R., Wanginiak, T. C. R.(2010) Proposta de manejo de Araucaria angustifolia utilizando o quociente de Liocourt e análise de incremento, em propriedade rural no Município de Lages, SC. Pesquisa Florestal Brasileira, v. 30, n. 64, p. 337-345. http://dx.doi.org/10.4336/2010.pfb.30.64.337
Higuchi, N., Chambers, J., Santos, J., Ribeiro, R. J., Pinto, A. C. M., Silva, R. P., Rocha, R. M., Tribuzy, E. S. (2004) Dinâmica e balanço do carbono da vegetação primária da Amazônia Central. Revista Floresta, 34 (3): 295-304.
Higuchi, N., Santos, J., Ribeiro, R. J., Minette, L., Biot, Y. (1998) Biomassa da parte aérea da vegetação da floresta tropical úmida de terra-firma da Amazônia brasileira. Acta Amazônica28: 153–166.
Higuchi, N., Pereira, H. S., Santos, J., Lima, A. J. N., Higuchi, F. G., Higuchi, M. I. G., Ayres, I. G. S. S.(2009) Governos locais amazônicos e as questões climáticas globais. Capítulo 6 - Estudo de caso 1, Estoque e dinâmica do carbono da floresta do Estado do Amazonas, 69-70 p.. Manaus.
IBAMA (Instituto Brasileiro do Meio Ambiente e dos Recursos Naturais Renováveis). Norma de Execução nº 01 de 24 de abril de 2007. Brasília, 26 p. 2007.
Keeling, H.C. Baker, T. R., Martinez, R. V., Monteagudo, A., Phillips, O. L. (2008) Contrasting patterns of diameter and biomass increment across tree functional groups in Amazonian forests. Oecologia, nº 158, p. 521–534.
Keller, M., Palace, M., Hurt, G. (December 2001) Biomass estimation in the Tapajós National Forest, Brazil examination of sampling and allometric uncertainties. Forest Ecology and Management. v.154, n.3, p. 371-382.
Koehler, H. S., Watzlawick, L. F., Kirchner, F. F., Valério A. F. (2005) Fontes de erros na estimativa de biomassa e carbono fixado em floresta Ombrófila mista. Biomassa e Energia, v. 2, n. 1, p. 69-77.
Korning, J., Balslev, H. (1994) Growth rates and mortality patterns of tropical lowland tree species and the relation to forest structure in Amazonian Ecuador. Journal of Tropical Ecology, v.10, p 151-166.
Lima, A. J. N., Suwa, R., Ribeiro, M. P. H. G., Kajimoto, T., Santos, J., Silva, R. P. Da, Souza, C. A., Barros, P. C., Noguchi, H., Ishizuka, M., Higuchi, N. (2012) Allometric models for estimating above- and below-ground biomass in Amazonian forests at São Gabriel da Cachoeira in the upper Rio Negro. Forest Ecology and Management, v. 277, p. 163-172.
Nogueira, E. M., Fearnside, P. M., Nelson, B. W., Barbosa, R. I., Keizer, E. W. H. (2008) Estimates of forest biomass in the Brazilian Amazon: new allometric equations and adjustments to biomass from wood-volume inventories. For. Ecol. Manage.256, 1853–1867.
Poorter, L. (1999) Growth responses of 15 rain-forest tree species to a light gradient: the relative importance of morphological and physiological traits. Functional Ecology v.13, p. 396-410.
Ramankutty, N., Gibbs, H. K., Achard, F., DeFries, R., Foley, J. A., Houghton, R. (2007) Challenges to estimating carbon emissions from tropical deforestation. Global Change Biology, v.13, n.1, p.51 66.
Reis, L. P., Ruschel, A. R., Silva, J. N. M., Reis, P. C. M., Carvalho, J. O. P., Soares, M. H. M. (2014) Dinâmica da distribuição diamétrica de algumas espécies de Sapotaceae após exploração florestal na Amazônia Oriental. Revista de Ciências Agrárias, v. 57, n. 3, p.234 – 243.
Rozendaal, D. M. A., Hurtado V. H., Poorter, L. (2006) Plasticity in leaf traits of 38 tropical tree species in response to light, relationships with light demand and adult stature. Functional Ecology, 20, p. 207–216.
Silva, J. N. M., Silva, S. M. A., Costa, D. H. M. (2001) Crescimento, mortalidade e recrutamento em florestas de terra firme da Amazônia Oriental: observações nas regiões do Tapajós e Jari. In: José Natalino Macedo Silva, João Olegário Pereira de Carvalho, Jorge Alberto Gazel Yared. (Org.). A silvicultura na Amazônia Oriental. 1 ed. Belém: EMBRAPA Amazônia Oriental/ DIFID, v. , p. 291-308.
Silva, R. P. 2007. Alometria, estoque e dinâmica da biomassa de florestas primárias e secundárias na região de Manaus(AM). Tese (doutorado)-- INPA/UFAM, Manaus.
Soares, C. P. B., Neto, F. P., Souza, A. L. 2006. Dendrometria e Inventário Florestal. Editora UFV, 276 p.
Souza, C. R., azevedo, C. P., Rossi, L. M. B., Silva, K. E., Santos, J., Higuchi, N. (2012) Dinâmica florestal e estoque de carbono em floresta primária na região de Manaus/AM. Acta Amazonica, v. 42, p. 501-506.
Valladares, F., Niinemets, Ü. (2008) Shade Tolerance, a Key Plant Feature of Complex Nature and Consequences. Annual Review of Ecology and Evolution, 39: 237-257.
Vieira, D. S., Gama, J. R. V., Oliveira, M. L. R., Ribeiro, R. B. S. (2015) Análise estrutural e uso múltiplo de espécies arbóreas em florestas manejadas no médio vale do rio Curuá-Una, Pará. Floresta, v.45, n.3, p. 465–476.
Vieira, S., De Camargo, P., Selhorst, D., Da Silva, R., Hutyra, L., Chambers, J. et al. (2004) Forest structure and carbon dynamics in Amazonian tropical rain forests. Oecologia, 140, 468–479.
Vieira, S. Trumbore, S., Camargo, P. B., Selhorst, D., Chambers, J. Q., Higuchi, N., Martinelli, L. A. (December, 2005) Slow growth rates of Amazonian trees: Consequences for carbon cycling. Proceedings of the national academy of Sciences the Unided State of America (PNAS) vol. 102, n. 51
Whitmore, T.C. (1998) An introduction to tropical rain forests. Oxford: Oxford Unicersity Press, Second Edition,
1. Doutorando do programa de pós-graduação Ciências de Florestas Tropicais, do Instituto Nacional de Pesquisa da Amazônia (INPA) e-mail: dribeiroaguiar@yahoo.com.br
2. Docente da Universidade Federal do Oeste do Pará (UFOPA), Instituto de Biodiversidades e Floresta, e-mail: jrvgama@gmail.com
3. Docente da Universidade Federal do Oeste do Pará (UFOPA), Instituto de Biodiversidades e Floresta, e-mail: tpbeldini@yahoo.com